SENYAWA ORGANOMETALIC (ORGANOLOGAM)
Kimia organologam adalah
ilmu kimia yang mempelajari tentang logam yang berikatan langsung dengan satu
atau lebih atom carbon. Beberapa senyawa organologam ada yang tidak
berikatan lansung dengan atom karbon seperti pada kompleks phospine, logam hidrida,
organosilikon, organoboron dan lainnya. Ada beberapa logam yang berikatan
langsung dengan unsur karbonnya namun bukan termasuk senyawa organologam, yaitu
logam karbida dan logam sianida. Fungsi utama senyawa organologam adalah
sebagai katalis pada reaksi kimia.
Terdapat dua macam ikatan organologam, yaitu
:
·
Ikatan ionik.
Ikatan ionik organologam terbentuk dari unsur yang sangat elektropositif yaitu unsur
pada golongan I, II, dan III. Organologam dengan yang berikatan secara ionik
bersifat tak larut dalam pelarut hidrokarbon dan mudah teroksidasi.
·
Ikatan kovalen. Ikatan
kovalen organologam yang mudah menguap terbentuk dari logam Zn, Cd,
Hg, dan logam non-transisi gologan III (kecuali aluminium), IV, dan V. Ikatan
kovalen ini terbentuk dengan cara memberikan satu elektron tunggalnya, baik
dari logam maupun unsur organiknya, untuk dipakai secara bersama. Sifat dari
senyawa organologam dengan ikatan kovalen ini mudah menguap, larut dalam
pelarut organik, dan tidak larut dalam air.
Sifat senyawa organologam yang umum
ialah atom karbon yang lebih elektronegatif daripada kebanyakan logamnya.
Senyawa komplek logam (biasanya logam-logam transisi) merupakan senyawa yang
memiliki satu atau lebih ikatan logam-karbon. Senyawa organologam terdiri dari
atom pusat dan ligan.
Terdapat beberapa kecenderungan
jenis-jenis ikatan yang terbentuk pada senyawaan organologam:
a. Senyawaan
ionik dari logam elektropositif
Garam logam ion-ion karbon yang
kestabilannya diperkuat oleh delokalisasi elektron lebih stabil walaupun masih relatif
reaktif. Adapun contoh gugus organik dalam garam-garaman tersebut seperti
(C6H5)3 C-Na+ dan
(C5H5)2Ca2+
b. Senyawaan
yang memiliki ikatan -σ (sigma)
Senyawaan
organologam dimana sisa organiknya terikat pada suatu atom logam
dengan suatu ikatan yang digolongkan sebagai ikatan kovalen (walaupun masih ada
karakter-karakter ionik dari senyawaan ini) yang dibentuk oleh kebanyakan logam
dengan keelektropositifan yang relatif lebih rendah dari golongan pertama di
atas.
Pada dasarnya Organologam prinsipnya
yaitu atom-atom Karbon dari gugus organik terikat kepada atom logam. Konsep ini
yang mendasari Organologam, sehingga banyak cara untuk menghasilkan
ikatan-ikatan logam pada Carbon yang berguna bagi kedua logam transisi dan
non-transisi. Beberapa yang lebih penting adalah sebagai berikut:
1. Reaksi
Logam langsung ; sintesis yang paling awal oleh ahli kimia Inggris,
Frankland dalam tahun 1845 adalah interaksi antara Zn dan suatu alkil
Halida. Adapun yang lebih berguna adalah penemuan ahli kimia Perancis, Grignard
yang dikenal sebagai pereaksi Grignard. Contohnya interaksi Magnesium dan alkil
atau aril Halida dalam eter:
Mg + CH3I → CH3MgI
Interaksi
langsung alkil atau aril Halida juga terjadi dengan Li, Na, K, Ca, Zn dan Cd.
2. Penggunaan
zat pengalkilasi. Senyawa ini dimanfaatkan untuk membuat senyawa organologam
lainnya. Kebanyakan Halida nonlogam dan logam atau turunan Halida dapat
dialkilasi dalam eter atau pelarut hidrokarbon, misalnya :
PCl3 + 3C6H5MgCl →
P(C6H5)3 + 3MgCl2
VOCl3 + 3(CH3)3SiCH2MgCl
→ VO(CH2SiMe3)3 + 3MgCl2
3. Interaksi
Hidrida Logam atau nonlogam dengan alkena atau alkuna.
4. Reaksi
Oksidatif adisi. Reaksi yang dikenal sebagai reaksi Oksa dimana Alkil atau Aril
Halida ditambahkan pada senyawa logam transisi Koordinasi tidak jenuh
menghasilkan ikatan logam Karbon. Contohnya:
RhCl(PPh3)3 + CH3I →
RhCl (CH3) (PPh3)2 + PPh3
5. Reaksi
Insersi yaitu reaksi yang menghasilkan ikatan-ikatan dengan Karbon, sebagai
contoh:
SbCl5 + 2HCCH → Cl3Sb
(CH=CHCl)2
Reaksi Grignard ditemukan oleh
kimiawan Perancis Auguste Victor Grignard (1871-1935) di tahun 1901. Tahap awal
reaksi adalah reaksi pembentukan metil magnesium iodida, reagen Grignard, dari
reaksi antara alkil halida (metil iodida dalam contoh di bawah ini) dan
magnesium dalam dietil eter kering.
CH3I + Mg → CH3MgI
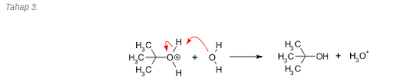
Anda pasti melihat bahwa
magnisium terikat langsung dengan karbon. Senyawa semacam ini yang sering
disebut sebagai reagen Grignard dengan ikatan C-logam dimasukkan dalam golongan
senyawa organologam. Ikatan C-logam sangat labil dan mudah menghasilkan
karbanion seperti CH3- setelah putusnya ikatan logam-karbon. Ion karbanion
cenderung menyerang atom karbon bermuatan positif. Telah dikenal luas bahwa
atom karbon gugus aldehida atau gugus keton bermuatan positif. karena berikatan dengan atom oksigen yang elektronegatif. Atom karbon
ini akan diserang oleh karbanion menghasilkan adduct yang akan menghasilkan
alkohol sekunder dari aldehida atau alkohol tersier dari keton setelah
hidrolisis.
C6H5CHO
+ CH3MgI → C6H5CH (CH3)
OMgI
Reaksi
Grignard adalah contoh reaksi senyawa organologam. Karena berbagai jenis
aldehida dan keton mudah didapat, berbagai senyawa organik dapat disintesis
dengan bantuan reaksi Grignard.
Tabel
2.1 Senyawa komplek organologam dengan perbedaan ligan, geometri, dan reaksi
yang dapat dikatalisisnya
Pada kompleks logam ada
tiga jenis keadaan tereksitasi yaitu:
a. Logam-centered
(MC), eksitasi elektron dari T2g ke orbital Eg,
b. Ligan-centered
(LC) yang menyatakan transisi dari p-p*,
c. Transfer
elektron dari logam ke ligan (MLCT).
JENIS - JENIS SENYAWA
ORGANOLOGAM
A. Senyawa
Organotimah
Senyawa organotimah adalah senyawa organometalik
yang disusun oleh satu atau lebih ikatan antara atom timah dengan atom karbon
(Sn-C). Senyawa ini umumnya adalah senyawa antropogenik, kecuali metiltin yang
mungkin dihasilkan melalui biometilasi di lingkungan. Atom Sn dalam senyawa
organotimah umumnya berada dalam tingkat oksidasi +4. Rumus struktur senyawa
organotimah adalah RnSnX4-n (n=1-4), dengan R adalah gugus alkil atau aril
(seperti: metil, butil, fenil, oktil), sedangkan X adalah spesies anionik
(seperti: klorida, oksida, hidroksida, merkaptoester, karboksilat, dan
sulfida). Bertambahnya bilangan koordinasi bagi timah dimungkinkan terjadi,
karena atomnya memiliki orbital d (Sudaryanto, 2001). Tetraorganotimah dan
triorganotimah klorida umumnya digunakan sebagai intermediet pada preparasi
senyawaan organotimah lainnya. Tetrafeniltimah larut dalam pelarut organik dan
tidak larut dalam air. Senyawaan organotimah cenderung memiliki karakter satu
atau lebih ikatan kovalen antara timah dan karbon.
Dari sisi fisika dan kimia, senyawa organotimah
merupakan monomer yang dapat membentuk makromolekul stabil, padat (metiltimah,
feniltimah, dan dimetiltimah) dan cairan (butiltimah) yang sangat mudah
menguap, menyublim, dan tidak berwarna serta stabil terhadap hidrolisis dan
oksidasi. Atom halogen, khususnya klor yang dimiliki oleh senyawa organotimah
mudah lepas dan berikatan dengan senyawa-senyawa yang mengandung atom dari
golongan IA atau golongan IIA sistem periodik atau ion logam positif lainnya.
Meskipun kekuatan ikatannya bervariasi, akan tetapi atas dasar sifat itulah
senyawa-senyawa turunan organotimah dapat disintesis (Grenwood and Earshaw,
1990). Beberapa metode untuk sintesis senyawaan organotimah telah banyak
dikenal. Starting material (material awal) seperti SnCl4 dan
triorganotimah halida lazim digunakan sebagai starting material untuk
mensintesis berbagai senyawaan organotimah. Beberapa metode yang umum digunakan
diantaranya:
- Metode Grignard, metode ini merupakan metode pertama yang dilakukan di USA dan Eropa Barat dalam memproduksi senyawaan organotimah. Metode ini memerlukan kondisi reaksi yang inert, jauh dari nyala api secara langsung, dan bersifat in situ.
- Metode Wurst, persamaan reaksinya dituliskan sebagai berikut:
- Metode dengan menggunakan reagen alkil aluminium, metode ini mulai dikenal pada awal tahun 1960-an. Adapun persamaan reaksinya dituliskan sebagai berikut:
1. Senyawa
organotimah halida
Senyawa Organotimah
halida dengan rumus umum RnSnX4-n (n = 1-3; X = Cl,
Br, I) pada umumnya merupakan padatan kristalin dan sangat reaktif. Organotimah halida ini dapat disintesis secara langsung melalui logam timah, Sn(II) atau Sn(IV) dengan alkil halida yang reaktif. Metode ini secara luas digunakan untuk pembuatan dialkiltimah dihalida. Sintesis langsung ini ditinjau ulang oleh Murphy dan Poller melalui persamaan reaksi:
Br, I) pada umumnya merupakan padatan kristalin dan sangat reaktif. Organotimah halida ini dapat disintesis secara langsung melalui logam timah, Sn(II) atau Sn(IV) dengan alkil halida yang reaktif. Metode ini secara luas digunakan untuk pembuatan dialkiltimah dihalida. Sintesis langsung ini ditinjau ulang oleh Murphy dan Poller melalui persamaan reaksi:
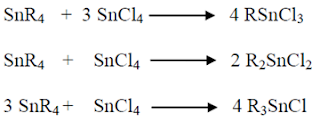
Metode lain yang sering
digunakan untuk pembuatan organotimah halida adalah reaksi disproporsionasi
tetraalkiltimah dangan timah(IV) klorida. Caranya dengan mengubah perbandingan
material awal, seperti pada persamaan reaksi berikut:
Ketiga persamaan reaksi
di atas merupakan reaksi redistribusi Kocheshkov. Reaksinya berlangsung dalam
atmosfer bebas uap air. Yield yang diperoleh dengan metode di atas cukup
tinggi. Senyawa organotimah klorida digunakan sebagai kloridanya dengan memakai
logam halida lain yang sesuai seperti ditunjukkan pada persamaan reaksi
berikut:
2. Senyawa
organotimah hidroksida dan oksida
Produk kompleks yang diperoleh melalui hidrolisis dari trialkiltimah halida dan senyawa yang berikatan R3SnX merupakan rute utama pada trialkiltimah oksida dan trialkiltimah hidroksida. Prinsip tahapan intermediet ditunjukkan pada reaksi berikut ini:
3. Senyawa
organotimah karboksilat
Senyawa organotimah karboksilat pada umumnya dapat disintesis melalui dua cara yaitu dari organotimah oksida atau organotimah hidroksidanya dengan asam karboksilat, dan dari organotimah halidanya dengan garam karboksilat. Metode yang biasa digunakan untuk sintesis organotimah karboksilat adalah dengan menggunakan organotimah halida sebagai material awal. Organotimah halida direaksikan dengan garam karboksilat dalam pelarut yang sesuai, biasanya aseton atau karbon tetraklorida. Reaksinya adalah sebagai berikut:
Reaksi esterifikasi dari asam karboksilat dengan organotimah oksida atau hidroksida dilakukan melalui dehidrasi azeotropik dari reaktan dalam toluena, seperti ditunjukkan pada reaksi berikut:
4. Aplikasi
Senyawa Organotimah
Senyawa organotimah memiliki aplikasi yang luas dalam kehidupan sehari-hari. Aplikasi senyawa organotimah dalam industri antara lain sebagai senyawa stabilizer polivinilklorida, pestisida nonsistematik, katalis antioksidan, antifouling agents dalam cat, stabilizer pada plastik dan karet sintetik, stabilizer untuk parfum dan berbagai macam peralatan yang berhubungan dengan medis dan gigi. Untuk penggunaan tersebut, kurang lebih 25.000 ton timah dipergunakan per tahun(Pellerito and Nagy, 2002).
Senyawa organotimah yang
umum digunakan sebagai katalis dalam sintesis kimia yaitu katalis mono- dan
diorganotimah. Senyawa organotimah merupakan katalis yang bersifat homogen yang
baik untuk pembuatan polisilikon, poliuretan, dan untuk sintesis poliester (Van
der Weij, 1981).
Dalam beberapa
penelitian, telah didapat dan diisolasi senyawa organotimah(IV) karboksilat
yang menunjukkan sifat sebagai antimikroorganisme sehingga dapat berfungsi
sebagai antifungi dan antimikroba (Bonire et al., 1998). Diketahui kompleks di-
dan triorganotimah halida dengan berbagai ligan yang mengandung nitrogen,
oksigen, dan sulfur memiliki aktivitas biologi dan farmakologi, serta digunakan
sebagai fungisida dalam pertanian, bakterisida, dan agen antitumor (Jain
et al., 2002).
B. Logam
Transisi
1. Alkil dan
Aril Litium (Organolitium)
Senyawa Organolitium
adalah senyawa Logam Alkali yang mempunyai sifat kelarutan dalam Hidrokarbon
atau cairan nonpolar dan penguapan yang tinggi serta mempunyai sifat khas zat
Kovalen. Penggabungan Molekular adalah suatu keistimewaan yang penting dari
alkil baik dalam kristal maupun larutan. Jadi dalam Metil lithium atom-atom Li
terletak pada sudut-sudut sebuah tetrahedron dengan gugus alkil berpusat pada
bidang dihadapannya. Gugus CH3 secara simetris terikat pada
tiga atom Li, dan ikatan jembatan alkil ini adalah dari jenis tuna elektron
berpusat banyak.
Dalam larutan, sifat
spesies terpolimerisasi bergantung pada pelarut, sifat sterik dari radikal
organik dan suhu. Dalam Hidrokarbon MeLi, EtLi, n-PrLI, dan beberapa
lainnya adalah heksamer, namun tert-butilitihium, yang tersolfasi. Tidak
terdapat agregat yang lebih kecil dari pada tetramet. Meskipun demikian,
bilamana digunakan pengkelatan amin ditersier, seperti tetrametiletilendiamen
(TMED), Me2NCH2CH2NMe2 diperoleh
kompleks alkillithium monomer yang stabil. Alkil dan aril juga membentuk
kompleks dengan alkil logam lain seperti kompleks dengan Mg dan Zn. Sebagai
contoh:
2. Senyawa
Organo-Natrium dan Kalium
Semua
senyawa ini benar-benar ionik dan tidak larut sampai batas apa pun dalam
hidrokarbon karena sangat reaktif, peka terhadap udara, dan terhidrolisis kuat
dalam air. Yang terpenting adalah senyawa natrium dari hidrokarbon asam
seperti siklopentadiena, idena, asitilena, dan sejenisnya. Ini diperoleh dari
interaksi dengan logam natrium atau natrium yang dihamburkan dalam
tetrahidrofuran atau dimetilformamida.
3. Magnesium
Senyawa organik dari Ca,Sr, dan Ba sangat ionik dan relatif tidak berguna,
namun senyawa magnesium mungkin adalah yang dipakai paling lias sebagai senyawa
organik yang digunakan sangat luas dalam kimia organik dan dalam sintesis
senyawa alkil dan aril dari unsur-unsur lain. Senyawa ini adalah jenis RMgX
(pereaksi Grignard) dan MgR2. Yang pertama dibuat dengan interaksi
langsung logam dengan suatu halida organik RX dalam suatu pelarut yang cocok,
biasanya suatu eter seperti dietil eter atau tetrahidrofuran. Reaksinya
biasanya paling cepat dalam iodida, RI, dan iod dapat digunakan sebagai suatu
Permasalahan :
1.
Jelaskan secara terperinci prinsip organologam
itu sendiri?
2.
Mengapa Organologam dengan yang berikatan
secara ionik bersifat tak larut dalam pelarut hidrokarbon dan mudah
teroksidasi.?
3.
Sebutkan jenis-jenis senyawa organologam
beserta penjelasan singkat yang jelas!
4. ada dua macam ikatan organologam yaitu ikatan kovalen dan ionik, jelaskan maksudnya!
4. ada dua macam ikatan organologam yaitu ikatan kovalen dan ionik, jelaskan maksudnya!