Elektrofil
Elektrofil
merupakan sesuatu yang tertarik pada elektron, Dan karena tertarik oleh daerah
negatif, elektrofil harus merupakan sesuatu yang memebawa muatan positif penuh
atau memiliki sedikit muatan positif disuatu daerah padanya.
Etena
dan alkena yang lain diserang oleh elektrofil. elektrofilk biasanya ujung yang
sedikit lebih positif ( +) dari sebuah molekul
seperti hidrogen bromida, HBr. Elektrofil tertarik dengan kuat ke elektron yang
terekpose pada ikatan pi dan reaksi terjadi karena adanya reaksi inisiasi yang
sebentar lagi akan kita bahas. Anda
mungkin bertanya mengapa Na+ tidak bereaksi dengan etena. Walaupun
ion ini tertarik dengan baik oleh ikatan pi, tidak ada kemungkinan proses akan
berlanjut antara natrium dan karbon, karena sodium membentuk ikatan ionik
dimana karbon membentuk ikatan kovalen.
+) dari sebuah molekul
seperti hidrogen bromida, HBr. Elektrofil tertarik dengan kuat ke elektron yang
terekpose pada ikatan pi dan reaksi terjadi karena adanya reaksi inisiasi yang
sebentar lagi akan kita bahas. Anda
mungkin bertanya mengapa Na+ tidak bereaksi dengan etena. Walaupun
ion ini tertarik dengan baik oleh ikatan pi, tidak ada kemungkinan proses akan
berlanjut antara natrium dan karbon, karena sodium membentuk ikatan ionik
dimana karbon membentuk ikatan kovalen.
Reaksi
Adisi
Struktur karbon lebih stabil pada ikatan
tunggal daripada pada ikatan rangkap. Ikatan pi sering terputus dan elektronnya
dipakai untuk berikatan dengan atom lain. I Sebagai contoh, dengan menggunakan
molekul yang umum X-Y.
Reaksi
Adisi Elektrofilik
Reaksi adisi merupakan reaksi dimana dua buah
molekul bergabung menghasilkan molekul yang lebih besar. Tidak ada yang hilang
selama proses berlangsung. Semua atom dari molekul awal dapat ditemukan pada
molekul hasil penggabungan. Reaksi adisi elektrofilik merupakan reaksi adisi
yang terjadi karena yang kita pikir sebagai molekul yang “penting” terserang
oleh elektrofil. Molekul yang “penting” tersebut memiliki daerah dengan
kepadatan elekton yang tinggi yang terserang oleh yang bermuatan positif.
Pada
senyawa alkena terdapat elektron π yang letaknya lebih jauh dari inti dibanding
elektron pada ikatan σ, sehingga lebih mudah diserang oleh suatu elektrofil.
Elektron pi adalah suatu nukleofil lemah.
Mekanisme reaksi adisi dari air terhadap
etilen, suatu alkena sederhana
Tahapan
Reaksi
Serangan
elektrofil terhadap ikatan π membentuk
suatu karbokation Serangan nukleofil
terhadap karbokation Tahap pertama
berjalan lambat, dan merupakan tahap penentu laju
Bila
alkena yang bereaksi adalah propena (alkena tak simetris karena substituen yang
terikat pada karbon alkena tidak sama), maka ada dua kemungkinan produk yang
terbentuk karena gugus OH dapat
masuk pada karbon
CH2 atau karbon CH3CH .
Kita
dapat mengatakan bahwa produk yang terbentuk lebih cepat akan menjadi produk
dominan dalam campuran. Dan kenyataannya kecepatan pembentukkan produk satu
100 kali lebih cepat dibanding produk yang lain. Sehingga secara teknis
praktis hanya satu produk yang dapat diamati. Dengan kata lain produk yang
diramalkan adalah produk yang laju pembentukannya lebih cepat. Masalahnya adalah
bila ada dua kemungkinan, kita harus bisa menentukan produk mana yang terjadi dengan
laju lebih cepat . Hal ini tergantung energi aktivasi untuk mencapai keadaan
teraktifkan . Reaksi dengan energi
keadaan transisi lebih rendah akan berlangsung lebih cepat dan
menghasilkan produk lebih melimpah.
Karbokation
sekunder lebih stabil (mempunyai tingkat energi lebih rendah) dibanding carbocation primer . Gugus metil
bersifat pendorong elektron yang membantu stabilisasi karbokation.
Secara
umum dapat dikatakan mekanisme reaksi adisi alkena adalah serangan electrophile pada karbon yang
kurang tersubstitusi pada tahap pertama
dan serangan nucleophile pada karbon yang lebih tersubstitusi pada tahap
kedua.
Mekanisme
ini dapat digunakan untuk memprediksi produk adisi terhadap alkena tak simetris
dengan syarat dapat menentukan gugus elektrofil dan nukleofil dari molekul yang
akan diadisikan pada alkena tersebut . Sebagai contoh adisi menggunakan
HBr . Ikatan dalam HBr bersifat
polar dengan H positive dan Br negative. H+ adalah elektrofil dan Br- adalah nukleofil.
Penerapan
dari mekanisme umum diatas adalah :
Metode
alternatif untuk membuat suatu alkohol primer
dikembangkan oleh H.C.Brown mengikuti rute di bawah:
Molekul
Halogen misalnya Cl2 dan Br2 juga dapat ditambahkan pada ikatan rangkap alkena. Pada kasus ini tidak
perlu mempertimbangkan orientasi
masuknya gugus karena gugus yang masuk identik
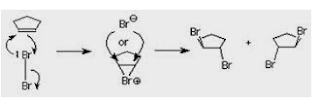
, tetapi aspek yang perlu dipahami adalah aspek stereokimia. Jika bromine ditambahkan pada cyclopentene,
ada dua kemungkinan produk yang dihasilkan tergantung orientasi ruang serangan kedua atom bromine. Bila dua atom
menyerang dari arah yang sama produk
yang terjadi adalah cis. Bila berlawanan
produk yang terbentuk adalah trans.
Hasil eksperimen menunjukkan produk yang terbentuk hanya trans .
Dari
hasil pengamatan disimpulkan mekanisme yang terjadi adalah :
Tahap
pertama
Tahap
kedua
Sama
dengan pada reaksi SN1 , serangan nukleofil terhadap karbokation dapat terjadi dari dua arah
sehingga dihasilkan produk campuran cis
dan trans.
Bila
eksperimen hanya menghasilkan satu jenis produk, berarti dapat disimpulkan
mekanisme reaksi tidak melalui pembentukan karbokation. Jadi harus ada
mekanisme lain yang menyebabkan terhalangnya serangan nukleofilik dari arah
yang sudah ada atom Br yang pertama. Ternyata pada tahap pertama atom Br
menyerang kedua atom karbon alkena. Satu ikatan menggunakan elektron pi dari
alkena, ikatan lain menggunakan elektron bebas Br. Hasilnya terbentuk
suatu siklik antara dua karbon alkena dan Br bentuk ini disebut ion brominium.
Serangan
Br selanjutnya sama dengan pada reaksi SN2.
Arah serangan adalah berlawanan dengan posisi Br yang pertama. Dan produk akhir
adalah trans .
Permasalahan :
1. Mengapa serangan nukleofil terhadap karbokation Tahap pertama
berjalan lambat, dan merupakan tahap
penentu laju ?
2.
Mengapa reaksi dengan energi dalam keadaan transisi lebih
rendah, akan berlangsung lebih cepat sehingga menghasilkan produk lebih
melimpah ?
3. Mengapa karbokation sekunder lebih stabil (mempunyai tingkat
energi lebih rendah) dibanding
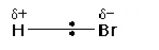













Saya akan mencoba menjawab permasalahan ke-3
BalasHapuskarena pada karbokation skunder tersebar muatan positifnya di banding denagn karbokation primer, maka semakin stabil ion tersebut.
Orde kestabilan karbokation
primer < sekunder < tersier
Kestabilan karbokation dari segi energi
Ketika kita berbicara tentang karbokation sekunder yang lebih stabil dari karbokation primer, kestabilan dalam hal apa yang sebenarnya kita maksudkan? Kestabilan yang dimaksud adalah kestabilan dari segi energi – karbokation sekunder berada pada tingkat yang lebih rendah dalam “tangga” energi dibanding karbokation primer.
Ini berarti bahwa akan diperlukan lebih banyak energi untuk membuat sebuah karbokation primer dibanding karbokation sekunder.
Saya akan menjawab permasalahan yang ke-1
BalasHapusKarena pada tahap reaksi pertama serangan elektrofil terhadap ikatan π membentuk suatu karbokation dan membentuk Serangan nukleofil terhadap karbokation Pada senyawa alkena terdapat elektron π yang letaknya lebih jauh dari inti dibanding elektron pada ikatan σ, sehingga lebih mudah diserang oleh suatu elektrofil. Elektron pi adalah suatu nukleofil lemah maka dari itu Tahap pertama berjalan lambat, dan merupakan tahap penentu laju.
baiklah, saya akan mencoba menjawab pertanyaan ke-2,
BalasHapuspada dasarnya dalam keadaan transisi karbokation yang berenergi rendah adalah karbokation sekunder Semakin besar konsentrasi suatu larutan, semakin banyak molekul yang terkandung di dalamnya. Dengan demikian, semakin sering terjadi tumbukan di antara molekul-molekul tersebut. Hal itu berarti hanya sebagian dari tumbukan molekul yang menghasilkan reaksi. Keadaan itu didasarkan pada 2 faktor, yaitu:
hanya molekul-molekul yang lebih energik yang akan menghasilkan reaksi sebagai hasil tumbukan;
kemungkinan suatu tumbukan tertentu untuk menghasilkan reaksi kimia tergantung dari orientasi molekul yang bertumbukan.
pada dasarnya dapat ditarik kesimpulan bahwasannya semakin rendah energi maka makin stabil dan sebaliknya. jika produk yang dihasilkan memiliki energi yang lebih tinggi dari reaktan maka produknya tidak stabil dan dapat membentuk produk yang baru. oleh karena tumbukan yang terjadi bersifat stabil maka produk yang dihasiolkan akan melimpan=h, sekian dan terima kasih :)