Asam amino adalah sembarang senyawa organik yang memiliki gugus fungsion alkarboksil (-COOH) dan amina(biasanya
-NH2). Dalam biokimia seringkali
pengertiannya dipersempit: keduanya terikat pada satu atom karbon (C)
yang sama (disebut atom C "alfa" atau α).
Gugus karboksil memberikan sifat asam dan
gugus amina memberikan sifat basa. Dalam bentuk
larutan, asam amino bersifat amfoterik: cenderung menjadi asam pada larutan
basa dan menjadi basa pada larutan asam. Perilaku ini terjadi karena asam amino
mampu menjadi zwitter-ion. Asam amino
termasuk golongan senyawa yang paling banyak dipelajari karena salah satu
fungsinya sangat penting dalam organisme, yaitu sebagai penyusun protein (Anonim, 2010).
Protein
merupakan polimer yang tersusun dari asam amino
sebagai monomernya. Monomer-monomer ini tersambung
dengan ikatan peptida,
yang mengikat gugus karboksil milik satu monomer dengan gugus amina milik
monomer di sebelahnya. Reaksi penyambungan ini (disebut translasi) secara alami terjadi di sitoplasma dengan bantuan ribosom dan tRNA.
Pada polimerisasi asam amino, gugus -OH yang merupakan bagian gugus karboksil
satu asam amino dan gugus -H yang merupakan bagian gugus amina asam amino
lainnya akan terlepas dan membentuk air. Oleh sebab itu, reaksi ini termasuk dalam
reaksi dehidrasi. Molekul asam amino yang telah
melepaskan molekul air dikatakan disebut dalam bentuk residu asam amino (Tim
Dosen Kimia, 2009).
Reaksi
kondensasi dua asam amino membentuk ikatan peptide
Pada
umumnya asam amino diperoleh sebagai hasil hidrolisis protein, baik menggunakan
enzim maupun dengan menggunakan asam, dengan cara ini diperoleh campuan
bermacam-macam asam amino dan untuk menentukan jenis asam amino maupun
kualitasnya masing-masing asam amino perlu diadakan pemisahan antara asam-asam
amino tersebut (Poedjiadi, 1994).
Seperti
halnya senyawa-senyawa lainnya, asam amino dan protein juga dapat
mengalami reaksi-reaksi spesifik. Reaksi- reaksi spesifik pada asam amino
dan protein pun ada beberapa macam antara lain reaksi dengan pereaksi millon,
ninhidrin, nitroprussida, sistin, sistein (Tim Dosen Kimia, 2009).
Ada
empat tingkat struktur dasar protein, yaitu struktur primer, sekunder, tersier,
dan kuartener. Struktur primer terkait mengenai
terbentuknya rantai-rantai dengan ikatan-ikatan peptida dimana jumlah,
macam, dan cara terkaitnya (urutan) asam-asam amino mempunyai peranan
penting. Struktur sekunder terkait mengenai
berlilitnya rantai-rantai polipeptida sampai terbentuknya suatu struktur
spiral karena terjadi ikatan hidrogen. Struktur tersier,
rantai-rantai polipeptida yang berlilit itu bergabung satu dengan yang
laindengan pertolongan ikatan yang lemah yakni ikatan hidrogen dan Van Der
Wals sampai terbentuknya lapisan, serat atau biji. Struktur kuartener,
tidak semua protein mempunyai struktur kuartener, hanya jika protein itu
terdisi atas 2 atau 4 rantai polipeptida yang tergabung oleh gaya bukan
ikatan kovalen (bukan ikatan peptide atau disulfida). Gaya yang
menstabilkan gabungan itu adalah ikatan hydrogen dan elektrostatik atau
ikatan garam. Struktur primer protein mempunyai rangkaian asam
amino dan komponen prostetik pembentuk protein. Struktur protein sekunder dan
tersier mengacu pada kedudukan tiga matra dari makromolekul; struktur kuartener
menyatakan susunan komplek protein aneka rantai. Sinarnya dan cara spektrum
yang modern lainnya terutama amat penting untuk menjelaskan ciri keruangan
protein. Struktur tersier suatu protein menggambarkan
perlipatannya rantai polipeptida. Perlipatan terdapat lebih acak daripada cirri
struktur sekundernya, tetapi dapat menunjukkan pola yang teratur. Ikatan
disulfida yang terbentuk di antara molekul sisterna memberikan pertautan
kovalen yang nisbi kuat mendukung struktur tersier. Protein globular
sebagaimana ditunjukkan oleh mieglobin, merupakan contoh yang menarik bagi
struktur tersier. Dimana berperan menyimpan dan mengalirkan oksigen . Ini
sangat erat kaitannya dengan haemoglobin yang merupakan protein yang rumit
(Stanley, 1988).
Ada
beberapa ciri molekul protein yaitu (Stanley, 1988) :
1) Berat
molekulnya besar, ribuan bahkan sampai jutaan, sehingga merupakan makromolekul.
2) Umumnya
terdiri dari 20 asam amino.Asam amino berikatan secara kovalen satu dengan yang
lainnya dalam variasi urutan-urutan yang bermacam-macam, membentuk suatu rantai
polipeptida. Ikatan peptida merupakan ikatan gugus karboksil dari asam amino
yang satu dengan asam amino lainnya.
3) Terdapatnya
ikatan kimia lain yang menyebabkan terbentuknya lengkungan-lengkungan
rantai polipeptida menjadi struktur 3 dimensi protein. Sebagai contoh ikatan
hidrogen, ikatan hidrofob/ikatan apolar, ikatan ion atau ikatan elektrostatik
dan ikatan Van der Waals.
4) Strukturnya
tidak stabil terhadap beberapa faktor seperti: pH, radiasi, temperatur, dan
medium pelarut.
5) Umumnya
reaktif dan sangat spesifik, disebabkan terdapatnya gugus samping yang reaktif
dan susunan khas struktur molekulnya.
6) Beraksi
positif terhadap pereaksi uji-uji yang spesifik seperti: Biuret, Ninhidrin dan
Millon, Xantoprotein, Sakaguchi, Adamkiewitz.
Denaturasi
ada dua macam yaitu (Lehninger,1990) :
- Pengembangan
rantai peptida dan pemecahan protein menjadi kecil tanpa diikuti pengembangan
molekul seperti pada polipeptida.
- Denaturasi
yang tergantung pada keadaan molekul seperti pada bagian molekul yang tergabung
dalam struktur sekunder.
Karena
itu denaturasi dapat berarti suatu perubahan atau modifikasi terhadap struktur
sekunder, tersier dan kuartener molekul protein tanpa terjadi pemecahan ikatan
kovalen. Atau dapat pula diartikan sebagai suatu proses pecahnya ikatan
hidrogen, interaksi hidrofobik, ikatan Van der Waals, dan terbuka
atau tidaknya ikatan molekul. Pada umumnya protein yang sudah didenaturasikan
kelarutannya berkurang atau hilang sama sekali, dan ada pula yang membentuk
endapan pada bagian dasar larutan. Hal ini disebabkan karena lapisan protein
bagian dalam yang bersifat hidrofobik terbalik keluar dan bagian luarnya yang
bersifat hidrofil terlipat ke dalam atau kebalikannya, terutama jika larutan
protein telah mendekati pada isoelektrik hingga protein menggumpal dan akhirnya
mengendap (Lehninger,1990).
Triptofan
merupakan satu dari 20 asam amino penyusun
protein yang bersifat esensial bagi manusia. Bentuk yang umum pada mamalia
adalah, seperti asam amino lainnya, L-triptofan. Meskipun demikian D-triptofan
ditemukan pula di alam (contohnya adalah pada bisa ular laut kontrifan).
Gugus fungsional yang dimiliki triptofan, indol,
tidak dimiliki asam-asam amino dasar lainnya. Akibatnya, triptofan menjadi
prekursor banyak senyawa biologis penting yang tersusun dalam kerangka indol.
Triptofan adalah prekursor melatonin (hormon perangsang tidur), serotonin (suatu transmiter pada sistem saraf) dan niasin (suatu vitamin). Indol adalah sebuah aromatik heterosiklik senyawa
organik. Bisiklik memiliki struktur, yang terdiri dari enam anggota benzencincin melebur
kelima-anggota nitrogen yang
mengandung pirol cincin. Indol adalah komponen populer wewangian dan
pendahulu untuk banyak obat-obatan. Senyawa yang mengandung sebuah cincin indol
disebut indoles. Derivatif yang paling terkenal adalah asam amino triptofan. Indol berbentuk padat pada suhu
kamar. Indole dapat diproduksi oleh bakteri sebagai
produk degradasi asam amino triptofan. Hal
ini terjadi secara alami di manusia tinja dan tinja yang
intens bau. Pada konsentrasi
yang sangat rendah, bagaimanapun, ia memiliki aroma bunga-bunga dan merupakan
konstituen dari banyak bunga aroma (seperti bunga
jeruk) dan parfum (Colby, 1985).
Bila
asam amino dalam makanan malampaui kebutuhan untuk sintesis protein dan
lintasan anabolik lainnya. Kelebihannya dikatabolisme untuk menentukan ATP atau
diubah menjadi substrak untuk sintesis asam lemak. Protein selular mengalami
“turn over” (dipecahkan dan diganti kembali) dengan kecepatan sekitar 400
gr/hari pada orang dewasa. Melalui suatu proses tertentu sejumlah asam amino dapat
membentuk suatu senyawa yang memiliki banyak ikatan peptida. Molekul senyawa
ini merupakan suatu molekul besar atau makromolekul yang terdiri atas banyak
molekul asam amino yang disebut juga sebagai polipeptida. Ada beberapa analisis
asam amino, misalnya metode gravitrimetri, kalorimetri, mikrobiologi,
kromatografi dan elekrofotolisis. Salah satu metode yang banyak digunakan dan
memperoleh perkembangan adalah metode kromatografi. Konsumsi protein diperlukan
untuk sumber nitrogen dalam tubuh, pembentukan zat-zat yang mengandung N
(nitrogenous) dan sebagai sumber asam amino esensial yang tidak dapat dibentuk
di dalam tubuh atau hanya dalam jumlah kecil saja untuk mensuplai kebutuhan
sehari-hari. Hampir semua nitrogen dari katabolisme protein asam amino
secara normal hilang dalam bentuk urea melalui ekskresi urine walaupun
jumlahnya terbuang dalam bentuk NH4+ dan keratin.
Gangguan metabolisme asam amino ditandai oleh kadar asam amino atau produk
metaboliknya yang abnormal dalam darah dan urine. Gangguan dalam metabolisme
asam amino sering menyebabkan retardasi mental dan gangguan perkembangan
(Linder, 1985).
Reaksi-reaksi
untuk mengidentifikasi asam amino dan protein antara lain:
a. Reaksi
sakaguci
Reaksi
sakaguci dilakukan dengan menggunakan pereaksi nafol dan natrium hipobromit.
Pada dasarnya reaksi ini dapat memberi hasil positif apabila ada gugus
guanidin. Jadi arginin atau protein yang mengandung arginin dapat menghasilkan
warna merah (Tim Dosen kimia, 2009)
b. Reaksi
Xantoprotein
Larutan
asam nitrat pekat ditambahkan dengan hati-hati ke dalam larutan protein.
Setelah dicampur terjadi endapan putih yang dapat berubah menjadi kuning
apabila dipanaskan. Reaksi yang terjadi adalah nitrasi pada inti benzena yang
terdapat pada molekul protein. Jadi reaksi ini positif jika mengandung tirosin,
fenil alanin dan triptofan (Poedjadi,1994).
Pereaksi
xantoprotein adalah larutan asam nitrat pekat. Jika larutan HNO3 pekat
dimasukkan ke dalam larutan protein secara
hati-hati, akan terbentuk endapan putih, dan berubah menjadi kuning jika
dipanaskan. Gejala ini akibat nitrasi pada inti benzena yang terdapat dalam
protein.
c. Reaksi
Hopkins-Cole
Triptofan
dapat berkondensasi dengan beberapa aldehida dengan bantuan asam kuat dan
membentuk senyawa yang berwarna. Larutan protein yang mengandung triptofan
dapat direasikan dengan pereaksi Hopkins-Cole yang mengandung asam glioksilat..
Setelah dicampur dengan pereaksi Hopkins-Cole, asam sulfat dituangkan
perlahan-lahan sehingga membentuk lapisan di bawah larutan protein. Beberapa
saat kemudian akan terjadi cincin ungu pada batas antara kedua lapisan. Reaksi
Hopkins-Cole memberi hasil positif khas untuk gugus indol dalam protein
(Poedjadi,1994).
Pereaksi
Hopkins-cole dibuat dari asam oksalat dan serbuk magnesium dalam air. Pereaksi
ini positif terhadap protein yang mengandung asam amino dengan gugus samping
indol, seperti pada asam amino triptofan.
Triptofan
memberikan hasil yang positif dengan tes Hopkins-cole karena mengandung gugus
indol.
Dalam
pereaksi ini, asam oksalat direduksi menjadi asam glioksilat dengan bantuan
katalis serbuk magnesium:
Asam
glioksilat yang terbentuk mengkondensasi asam amino triftofan membentuk senyawa
berwarna. Setelah H2SO4 pekat dituangkan, akan
terbentuk dua lapisan dan beberapa saat kemudian terbentuk cincin ungu di
antara batas kedua lapisan itu.
d.
Tes Millon
Pereaksi
Millon adalah campuran larutan raksa (I) nitrat dan raksa (II) nitrat dalam
asam nitrat. Jika pereaksi Millon ditambahkan ke dalam larutan protein, akan
dihasilkan endapan putih yang dapat berubah menjadi merah akibat pemanasan.
Tirosin
memberikan hasil yang positif dengan tes Millon karena mengandung gugus fenol.
Pereaksi ini positif untuk protein yang
mengandung asam amino dengan gugus samping senyawa fenol sebab terjadi reaksi
antara senyawa raksa (II) dengan gugus hidroksifenil membentuk senyawa
berwarna. Protein yang mengandung tirosin akan memberikan hasil positif.
e.
Tes Biuret
Larutan
protein memberikan hasil yang positif terhadap pereaksi biuret. Tes Biuret
dilakukan dengan cara menuangkan larutan natrium hidroksida pekat ke dalam
larutan protein. Kemudian, larutan CuSO4 ditambahkan
setetes demi setetes yang akan terbentuk warna ungu.
f.
Tes
Nitroprusida
Natrium
nitroprusida dalam larutan amonia akan menghasilkan warna merah dengan protein
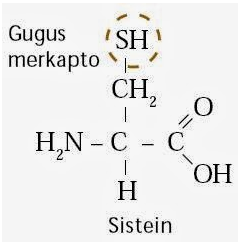
yang mempunyai gugus –SH bebas (merkapto). Jadi, protein yang mengandung
sistein akan memberikan hasil positif. Gugus –S–S– pada sistein apabila
direduksi terlebih dahulu dapat juga memberikan hasil positif.
Permasalahan:
1.
Ada empat tingkat struktur dasar
protein, sebutkan dan jeaskan!
2.
mengapa protein yang sudah
didenaturasikan kelarutannya berkurang atau hilang sama sekali, da nada yang membentuk endapan pada bagian
dasar larutan. Jeaskan!
3.
mengapa Tirosin akan memberikan hasil yang positif pada tes milon? Jeaskan !
4.
mengapa pada reaksi Hopkins-cole akan
terbentuk cincin ungu pada batas antara kedua lapisan. Dan reaksi Hopkins-Cole akan
memberikan hasil positif khas untuk
gugus indol dalam protein, jelaskan apa itu gugus indol!









Saya mencoba menjawab permasalahan 3.
BalasHapusTirosin akan memberikan hasil positif terhadap uji milon karena memang kegunaan uji milon sendiri yaitu untuk menunjukkan adanya asam amino tirosin pada suatu zat. Uji millon bekerja terhadap derivat-derivat monofenol seperti tirosin. Uji ini dikatakan positif jika terbentuknya senyawa merkuri dengan gugus hidroksifenil yang berwarna merah.
Izin menjawab pertanyaan no 1
BalasHapusTingkat Struktur dasar protein ada 4
1. Struktur primer merupakan struktur yang sederhana dengan urutan-urutan asam amino yang tersusun secara linear yang mirip seperti tatanan huruf dalam sebuah kata dan tidak terjadi percabangan rantai. Struktur primer terbentuk melalui ikatan antara gugus α–amino dengan gugus α–karboksil (Gambar 3). Ikatan tersebut dinamakan ikatan peptida atau ikatan amida (Berg et al., 2006; Lodish et al., 2003). Struktur ini dapat menentukan urutan suatu asam amino dari suatu polipeptida (Voet & Judith, 2009).
2.Struktur sekunder merupakan kombinasi antara struktur primer yang linear distabilkan oleh ikatan hidrogen antara gugus =CO dan =NH di sepanjang tulang belakang polipeptida. Salah satu contoh struktur sekunder adalah α-heliks dan β-pleated. Struktur ini memiliki segmen-segmen dalam polipeptida yang terlilit atau terlipat secara berulang. (Campbell et al., 2009; Conn, 2008).
3. Struktur tersier dari suatu protein adalah lapisan yang tumpang tindih di atas pola struktur sekunder yang terdiri atas pemutarbalikan tak beraturan dari ikatan antara rantai samping (gugus R) berbagai asam amino (Gambar 10). Struktur ini merupakan konformasi tiga dimensi yang mengacu pada hubungan spasial antar struktur sekunder. Struktur ini distabilkan oleh empat macam ikatan, yakni ikatan hidrogen, ikatan ionik, ikatan kovalen, dan ikatan hidrofobik. Dalam struktur ini, ikatan hidrofobik sangat penting bagi protein. Asam amino yang memiliki sifat hidrofobik akan berikatan di bagian dalam protein globuler yang tidak berikatan dengan air, sementara asam amino yang bersifat hodrofilik secara umum akan berada di sisi permukaan luar yang berikatan dengan air di sekelilingnya (Murray et al, 2009; Lehninger et al, 2004).
4.Struktur kuarterner adalah gambaran dari pengaturan sub-unit atau promoter protein dalam ruang. Struktur ini memiliki dua atau lebih dari sub-unit protein dengan struktur tersier yang akan membentuk protein kompleks yang fungsional. ikatan yang berperan dalam struktur ini adalah ikatan nonkovalen, yakni interaksi elektrostatis, hidrogen, dan hidrofobik. Protein dengan struktur kuarterner sering disebut juga dengan protein multimerik. Jika protein yang tersusun dari dua sub-unit disebut dengan protein dimerik dan jika tersusun dari empat sub-unit disebut dengan protein tetramerik (Gambar 11) (Lodish et al., 2003; Murray et al, 2009).
Baik saya akan menjawab permasalahan yang ke 4
BalasHapusHal tersebut dikarenakan triptofan dapat berkondensasi dengan beberapa aldehida dengan bantuan asam kuat dan membentuk senyawa yang berwarna. Larutan protein yang mengandung triptofan dapat direasikan dengan pereaksi Hopkins-Cole yang mengandung asam glioksilat.. Setelah dicampur dengan pereaksi Hopkins-Cole, asam sulfat dituangkan perlahan-lahan sehingga membentuk lapisan di bawah larutan protein.
Indol berperan penting dan banyak digunakan pada bidang kimia karena hubungannya dengan pewarna alami yaitu indigo. Degradasi kimiawi dari pewarna ini akan menghasilkan indoksil, oksindol, dan akhirnya senyawa indol
Jawaban permasalahan no. 2 :
BalasHapusPada umumnya protein yang sudah didenaturasikan kelarutannya berkurang atau hilang sama sekali, dan ada pula yang membentuk endapan pada bagian dasar larutan. Hal ini disebabkan karena lapisan protein bagian dalam yang bersifat hidrofobik terbalik keluar dan bagian luarnya yang bersifat hidrofil terlipat ke dalam atau kebalikannya, terutama jika larutan protein telah mendekati pada isoelektrik hingga protein menggumpal dan akhirnya mengendap